Contenido
Los enlaces covalentes y los enlaces de hidrógeno son fuerzas intermoleculares primarias. Los enlaces covalentes pueden ocurrir entre la mayoría de los elementos en la tabla periódica. Los enlaces de hidrógeno son un enlace especial entre un átomo de hidrógeno y un átomo de oxígeno, nitrógeno o flúor.
Valencia
••• Jupiterimages / Photos.com / Getty ImagesEl poder de un elemento para combinarse con otros elementos está representado por un número asignado llamado valencia. Para los iones, la valencia es igual a la carga eléctrica. Por ejemplo, la valencia para el cloro es 3p5, por lo que fácilmente ganará un electrón, y el ion resultante es Cl-.
La regla del octeto


La regla del octeto se basa en la idea de que la configuración de gas noble (s2p6) es la más favorable y se puede lograr con la formación de enlaces de pares de electrones con otros átomos.
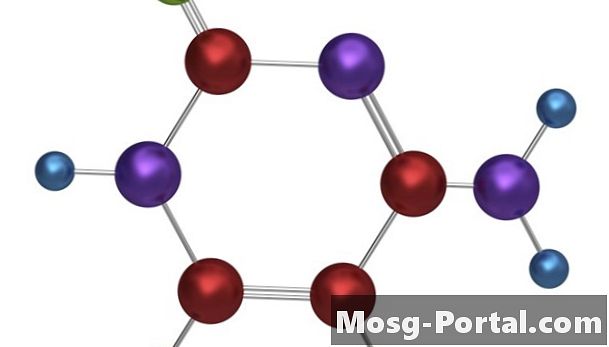
Bonos Covalentes
••• Tempusfugit / iStock / Getty ImagesLos enlaces covalentes se forman cuando dos o más átomos comparten electrones para llenar sus capas de electrones más externas.
Enlaces de hidrógeno


Un enlace de hidrógeno ocurre cuando la carga positiva parcial de un átomo de hidrógeno se une a una molécula electronegativa, generalmente oxígeno, nitrógeno o flúor.
Bonos de hidrógeno covalentes v.

Tanto los enlaces covalentes como los de hidrógeno son formas de fuerzas intermoleculares. Los enlaces covalentes pueden ocurrir con la mayoría de los elementos en la tabla periódica, mientras que los enlaces de hidrógeno generalmente ocurren entre un átomo de hidrógeno y una molécula de oxígeno, nitrógeno o flúor. Además, los enlaces de hidrógeno son solo aproximadamente 1/10 tan fuertes como un enlace covalente.