Contenido
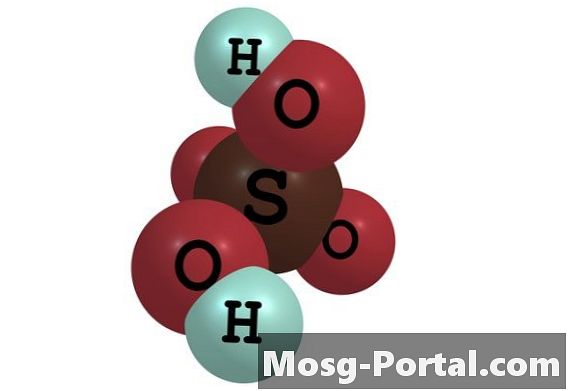
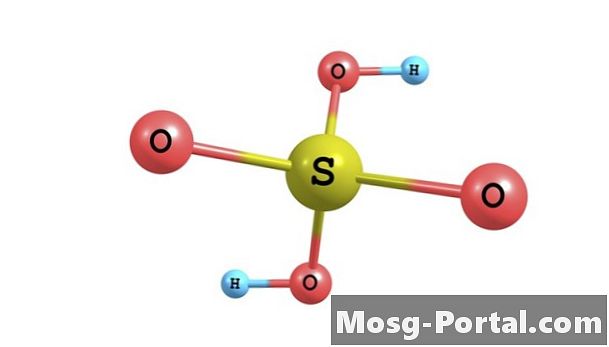
El ácido sulfúrico es un ácido inorgánico fuerte comúnmente utilizado en la producción industrial de productos químicos, en trabajos de investigación y en entornos de laboratorio. Tiene la fórmula molecular H2SO4. Es soluble en agua en todas las concentraciones para formar una solución de ácido sulfúrico. En la solución, un mol de ácido sulfúrico se separa en un mol de iones sulfato cargados negativamente, o SO4 (2-), y 2 moles de iones hidronio cargados positivamente, o H3O +. La concentración de estos iones se expresa en molaridad, que se define como el número de moles de iones por litro de solución. Su concentración depende de la concentración inicial de ácido sulfúrico.