Contenido
- Características generales de los catalizadores
- Catalizador Química
- Catálisis Homogénea
- Catálisis Heterogénea
- Enzimas
En química, un Catalizador es una sustancia que acelera la velocidad de una reacción sin ser consumida en la reacción. Cualquier reacción que hace uso de un catalizador se denomina catálisis. Tenga cuidado con esta distinción cuando lea material de química; un catalizador ("catalizadores" en plural) es una sustancia física, pero la catálisis ("catalizadores" en plural) es un proceso.
Una visión general de cada una de las clases de catalizadores es un punto de partida útil para aprender química analítica y comprender lo que sucede a nivel molecular cuando se mezclan sustancias y se produce una reacción. Los catalizadores y sus reacciones catalíticas asociadas se presentan en tres tipos principales: catalizadores homogéneos, catalizadores heterogéneos y biocatalizadores (generalmente llamados enzimas). Los tipos de actividades catalizadoras menos comunes pero aún importantes incluyen la fotocatálisis, la catálisis ambiental y los procesos catalíticos ecológicos.
Características generales de los catalizadores
La mayoría de los catalizadores sólidos son metales (por ejemplo, platino o níquel) o metales cercanos (por ejemplo, silicio, boro y aluminio) unidos a elementos tales como oxígeno y azufre. Los catalizadores que están en la fase líquida o gaseosa tienen más probabilidades de consistir en un solo elemento, aunque pueden combinarse con solventes y otro material, y los catalizadores sólidos pueden diseminarse dentro de una matriz sólida o líquida conocida como soporte catalítico.
Los catalizadores aceleran las reacciones al reducir el energía de activación miuna de una reacción que procedería sin el catalizador, pero mucho más lentamente. Dichas reacciones tienen un producto o productos con una energía total menor que la del reactivo o reactivos; Si este no fuera el caso, estas reacciones no ocurrirían sin la adición de energía externa. Pero para pasar del estado de mayor energía al estado de menor energía, los productos deben "superar la joroba" primero, esa "joroba" es la Euna. En esencia, los catalizadores suavizan los baches a lo largo del camino de la energía de reacción al facilitar que los reactivos lleguen a la energía "pendiente abajo" de la reacción simplemente bajando la elevación de la "cima de la colina".
Los sistemas químicos presentan ejemplos de catalizadores positivos y negativos, y los primeros tienden a acelerar la velocidad de la reacción y los catalizadores negativos sirven para desacelerarlos. Ambos pueden ser ventajosos, dependiendo del resultado específico deseado.
Catalizador Química
Los catalizadores llevan a cabo su trabajo uniéndose temporalmente o modificando químicamente uno de los reactivos y cambiando su conformación física, o forma tridimensional, de una manera que facilite la transformación del reactivo o reactivos en uno de los productos. Imagina tener un perro que ha rodado en el barro y necesita estar limpio antes de que pueda entrar. El lodo se desprendería del perro por sí solo eventualmente, pero si pudieras hacer algo que empujara al perro en dirección al aspersor de jardín para que el lodo se rociara rápidamente de su pelaje, habrías servido en efecto como un "catalizador "de la" reacción "del perro sucio al perro limpio.
Muy a menudo, un producto intermedio que no se muestra en ningún resumen ordinario de la reacción se forma a partir de un reactivo y el catalizador, y cuando este complejo se transforma en uno o más productos finales, el catalizador se regenera como si nada le hubiera pasado a nadie. en absoluto. Como verá en breve, este proceso puede tener lugar de varias maneras.
Catálisis Homogénea
Se considera una reacción. catalizado homogéneamente cuando el catalizador y el (los) reactivo (s) están en el mismo estado físico o fase. Esto ocurre con mayor frecuencia con pares de reactivos catalizadores gaseosos. Los tipos de catalizadores homogéneos incluyen ácidos orgánicos en los que el átomo de hidrógeno donado es reemplazado por un metal, una serie de compuestos que combinan carbono y elementos metálicos en alguna forma, y compuestos de carbonilo unidos a cobalto o hierro.
Un ejemplo de este tipo de catálisis que involucra líquidos es la conversión de iones persulfato y yoduro en iones sulfato y yodo:
S2O82- + 2 I- → 2 SO42- + I2
Esta reacción tendría dificultades para continuar por sí sola a pesar de la energía favorable, porque ambos reactivos están cargados negativamente y, por lo tanto, sus cualidades electrostáticas están en oposición a sus cualidades químicas. Pero si los iones de hierro, que llevan una carga positiva, se agregan a la mezcla, el hierro "distrae" las cargas negativas y la reacción avanza rápidamente.
Una catálisis homogénea gaseosa natural es la conversión de oxígeno gaseoso u O2, en la atmósfera a ozono, u O3, donde los radicales de oxígeno (O-) son intermedios. Aquí, la luz ultravioleta del sol es el verdadero catalizador, pero cada compuesto físico presente está en el mismo estado (gas).
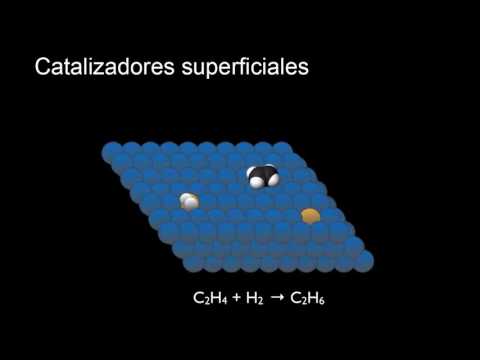
Catálisis Heterogénea
Se considera una reacción. catalizado heterogéneamente cuando el catalizador y el (los) reactivo (s) están en diferentes fases, con la reacción ocurriendo en la interfaz entre ellos (más comúnmente, el "borde" sólido gaseoso). Algunos de los catalizadores heterogéneos más comunes incluyen sólidos inorgánicos, es decir, que no contienen carbono, como metales elementales, sulfuros y sales metálicas, así como un puñado de sustancias orgánicas, entre ellas hidroperóxidos e intercambiadores de iones.
Las zeolitas son una clase importante de catalizadores heterogéneos. Estos son sólidos cristalinos compuestos de unidades repetitivas de SiO4. Las unidades de cuatro de estas moléculas unidas se unen para formar diferentes estructuras de anillo y jaula. La presencia de un átomo de aluminio en el cristal crea un desequilibrio de carga, que es compensado por un protón (es decir, un ion de hidrógeno).
Enzimas
Las enzimas son proteínas que funcionan como catalizadores en los sistemas vivos. Estas enzimas tienen componentes llamados sitios de unión al sustrato, o sitios activos, donde las moléculas involucradas en la reacción bajo catálisis se unen. Las partes componentes de todas las proteínas son aminoácidos, y cada uno de estos ácidos individuales tiene una distribución de carga desigual de un extremo al otro. Esta propiedad es la razón principal por la que las enzimas poseen capacidades catalíticas.
El sitio activo en la enzima encaja con la parte correcta del sustrato (reactivo) más bien como una llave que entra en una cerradura. Tenga en cuenta que los catalizadores descritos anteriormente a menudo catalizan una serie de reacciones diferentes y, por lo tanto, no poseen el grado de especificidad química que tienen las enzimas.
En general, cuando hay más sustrato y más enzima, la reacción se desarrollará más rápidamente. Pero si se agrega más y más sustrato sin agregar más enzima también, todos los sitios de unión enzimática se saturan y la reacción alcanza su velocidad máxima para esa concentración de enzima. Cada reacción catalizada por una enzima puede representarse en términos de los productos intermedios formados debido a la presencia de la enzima. Es decir, en lugar de escribir:
S → P
para mostrar un sustrato que se transforma en un producto, puede representar esto como:
E + S → ES → E + P
en donde el término medio es el complejo enzima-sustrato (ES).
Las enzimas, aunque clasificadas como una categoría de catalizador distinta de las mencionadas anteriormente, pueden ser homogéneas o heterogéneas.
Las enzimas funcionan de manera óptima dentro de un rango de temperatura estrecho, lo que tiene sentido dado que la temperatura de su cuerpo no fluctúa más de unos pocos grados en condiciones normales. El calor extremo destruye muchas enzimas y hace que pierdan su forma tridimensional específica, un proceso llamado desnaturalización que se aplica a todas las proteínas.