Contenido
El ozono, una forma de oxígeno, no es un compuesto abundante en la atmósfera terrestre, pero es importante. Forma una capa en la estratosfera que bloquea la dañina radiación solar ultravioleta, y sin esa capa, las condiciones en la superficie serían menos favorables para los seres vivos. La liberación de clorofluorocarbonos a la atmósfera daña esta capa de ozono, porque el cloro, un componente de los CFC, es altamente reactivo e interactúa con el ozono para convertirlo en moléculas de oxígeno ordinarias.
Ozono en la Atmósfera
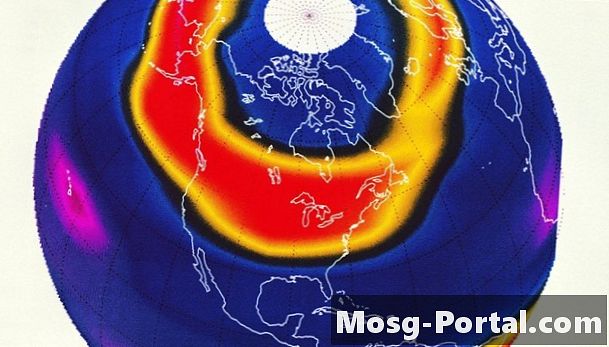
El ozono es un compuesto formado a partir de tres átomos de oxígeno, y existe en dos capas separadas en la atmósfera. En la troposfera, cerca del suelo, se considera un contaminante. Daña los cultivos y causa dolencias respiratorias en humanos. En la estratosfera superior, sin embargo, forma una capa que absorbe la luz solar ultravioleta. Los científicos miden el grosor de esta capa de ozono "bueno" en unidades Dobson, llamado así por el físico británico Gordon Miller Bourne Dobson, pionero en el estudio del ozono. Una unidad Dobson se define como un espesor de 0.01 milímetros (0.0004 pulgadas) a temperatura y presión estándar, que es de 0 grados Celsius (32 grados Fahrenheit) y 1 atmósfera.
Reacción con ozono
El cloro actúa como un catalizador para convertir el ozono en oxígeno en una reacción que no se entendió hasta 1973. Cuando un átomo de cloro libre y una molécula de ozono interactúan, el átomo de cloro elimina la tercera molécula de oxígeno para formar monóxido de cloro, un compuesto inestable, y deja un Molécula de oxígeno estable. Debido a que la molécula de monóxido de cloro es inestable, puede interactuar con un átomo de oxígeno libre para producir otra molécula que consta de dos átomos de oxígeno y, lo que es más importante, dejar el átomo de cloro libre para comenzar el proceso nuevamente. Este ciclo puede repetirse miles de veces, disminuyendo constantemente la cantidad de ozono.
Fuentes de cloro
Debido a que el cloro es inestable, si se libera en su forma elemental, reaccionaría con algún otro elemento o compuesto antes de llegar a la estratosfera. Sin embargo, el cloro es un elemento clave en una clase de sustancias llamadas clorofluorocarbonos, que tienen varias aplicaciones en la industria, incluida la refrigeración. A diferencia del cloro puro, los CFC son inertes y, cuando se liberan a nivel del suelo, retienen su estructura indefinidamente. Sin embargo, eventualmente migran a la atmósfera superior, donde la luz solar es lo suficientemente intensa como para separarlos y liberar cloro. El cloro no es necesariamente el único elemento que agota el ozono. El bromo, el hidrógeno y el nitrógeno también hacen esto.
La capa de ozono
El grosor de la capa de ozono promedia alrededor de 300 a 500 unidades Dobson, lo que corresponde aproximadamente al grosor de dos centavos apilados. En 1984, científicos británicos en la Antártida informaron un adelgazamiento recurrente de esta capa a 180 unidades Dobson, o un poco más que el grosor de un centavo. Este adelgazamiento ocurre durante el invierno y la primavera antárticos, cuando las nubes estratosféricas de partículas de hielo aceleran la destrucción del ozono. El agujero crece cada año para abarcar la mayor parte del continente antártico y más allá, y la capa se ha vuelto tan delgada como 73 unidades Dobson en algunos años, que es menos del grosor de una moneda de diez centavos.